Lorsqu’un dispositif médical ne respecte pas la législation ou la réglementation en vigueur ou lorsqu’ il est identifié comme présentant un risque pour la santé, un retrait du marché peut être prononcé par la DGCCRF ou l’ANSM. Sa mise sur le marché peut être suspendue pour une période déterminée ou interdite définitivement, par le biais d’une décision de police sanitaire prise par l’ANSM.
La législation prévoit une distinction entre dispositif médicaux (DM) et dispositifs médicaux de diagnostics in vitro (DMDIV). Un dispositif médical de diagnostic in vitro est un produit ou instrument destiné par son fabricant à être utilisé in vitro dans l’examen d’échantillons provenant du corps humain. Leur but étant de fournir une information, notamment, sur l’état physiologique ou pathologique d’une personne ou sur une anomalie congénitale. Les produits dénommés.
Définition et cadre réglementaire Qu’est-ce qu’un dispositif médical ? La définition du dispositif médical est fixée par la réglementation européenne. Il s’agit de produits de santé utilisés chez l’homme pour une finalité diagnostique ou thérapeutique, pour compenser un handicap ou comme moyen de maitrise de la conception.

Un dispositif médical correspond à tout instrument, appareil, équipement, matière, produit (à l’exception des produits d’origine humaine) y compris les accessoires et logiciels, utilisé seul ou en association, à des fins médicales chez l’homme, et dont l’action principale voulue n’est pas obtenue par des moyens pharmacologiques, immunologiques ou métaboliques. Dispositifs médicaux : tout connaitre de la réglementation. RÉGLEMENTATION TEXTE COMMUNAUTAIRE.
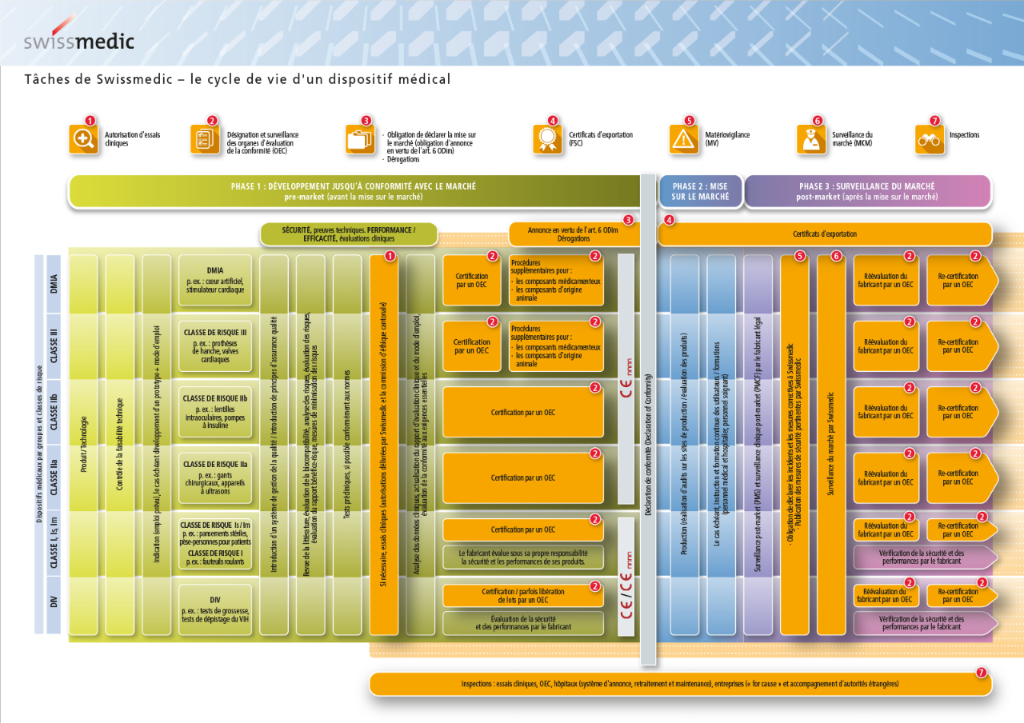
Définir la classe d’un dispositif médical (DM) est une nécessité pour tout fabricant, en Europe c’est cette classe qui va permettre de définir les contraintes pour établir la conformité du produit aux exigences réglementaires. Il existe quatre classes pour les DM, par ordre de criticité: I, IIa, IIb et III. Ceci implique qu’ils doivent être conformes aux directives relatives aux produits et porter le marquage CE. Réglementation Selon le risque associé à leur utilisation.
Un dispositif médical (DM), ou instrument médical au Canada, est une catégorie réglementaire de produits de santé dont les frontières sont différentes selon les pays. Nous avons commencé par réguler les importations parce que l’exclusivité d’importation n’est plus aux pharmaciens. La biocompatibilité a toujours été l’un des sujets majeurs du développement des dispositifs médicaux.
Nous pouvons toutefois constater des évolutions sur les méthodologies d’évaluation de dossiers techniques de nos clients par leurs Organismes Notifiés, qui placent plus que jamais le sujet de la biocompatibilité au cœur des évaluations, leur but étant de s’assurer de leur. Cette nouvelle règlementation prévoit une modification importante de l’environnement réglementaire du secteur des DM.

Exigences à des fins réglementaires. Régime juridique des dispositifs médicaux et dispositions connexes relatives à ces dispositifs : code de la santé publique Art. Parmi les produits connectés disponibles sur le marché, certains ont le statut de dispositifs médicaux (DM) compte tenu de leur finalité médicale, qu’elle soit thérapeutique ou diagnostique.
Leur usage contribue à améliorer la qualité et l’efficience de la prise en charge des patients en les affranchissant de certaines contraintes, par exemple en matière de temps et de lieux. Pour prétendre à un remboursement par la collectivité, ils doivent être évalués par la Commission. Acquérir une vision transversale de la réglementation sur les dispositifs médicaux en identifiant les différents textes et les échéances de mise en conformité réglementaires.
Se constituer un bagage réglementaire afin de piloter avec succès des projets sur les différentes étapes du cycle de vie d’un dispositif médical. Cette fiche présente les effets potentiels des champs électromagnétiques sur les travailleurs équipés de dispositifs médicaux, la réglementation en vigueur, ainsi que les mesures de prévention applicables en entreprise.
En effet, la réglementation actuelle, qui est européenne, et les contrôles applicables aux dispositifs médicaux sont ne permettent pas d’avoir une autorisation de mise sur le marché comme pour les médicaments. Qualité de vos soins A la différence des médicaments, la réglementation relative aux dispositifs médicaux (traçabilité, classification, marquage) n’impose pas d’AMM (Autorisation de Mise sur le Marché).
Leur évaluation et la promotion de leur bon usage sont actuellement des priorités pour les professionnels de santé. Le dispositif médical est différent d’un médicament par sa fonction.
Le mode d’action d’un dispositif médical est physique (par exemple : une action mécanique, le remplacement ou le soutien d’un organe). Davantage de pays adopteront des réglementations sur les dispositifs médicaux.
Hakim MEHALBI, Formateur - Auditeur dans les dispositifs médicaux. Ce dispositif français de surveillance d’entrée sur le marché permet d’avoir une visibilité en temps réel de l’arrivée de nouveaux dispositifs médicaux. Quelle est la réglementation française ? Elle intègre la notion nouvelle d’identifiant unique, également appelée en anglais « UDI » (Unique Device Identifier), permettant d’assurer une codification harmonisée et une meilleure.
Nous apportons des conseils stratégiques à toutes les étapes du processus de développement de produits. La réglementation relative aux dispositifs médicaux votée par le Parlement Européen (communiqué) GS, le mar.
Aucun commentaire:
Enregistrer un commentaire
Remarque : Seul un membre de ce blog est autorisé à enregistrer un commentaire.